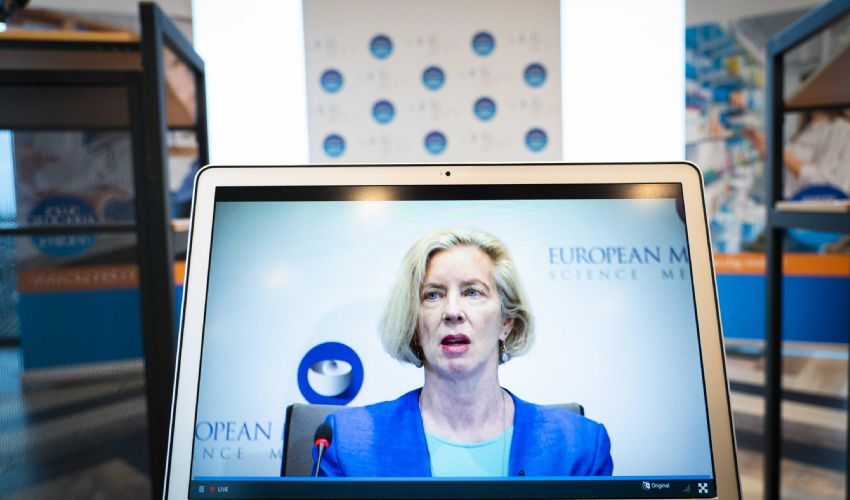
L’Agenzia europea del Farmaco ha dato luce verde al vaccino covid19 di AstraZeneca per i maggiori di 18 anni, raccomandando l’autorizzazione alla sua immissione in commercio condizionale. Un’autorizzazione formale che deve essere ora confermata dalla Commissione europea.
Lo ha annunciato nel pomeriggio Emer Cooke, Direttrice dell’Agenzia, illustrando i risultati combinati di 4 studi clinici condotti nel Regno Unito, Brasile e Sud Africa. Si è dimostrato che la formula del farmaco è stato sicuro ed efficace su circa 24.000 persone (in regime standard di somministrazione). Come da prassi scientifica, una metà ha ricevuto il vaccino, l’altra un’iniezione placebo oppure un altro farmaco che non cura il covid19.
Efficacia al 60% e tempi di inoculazione
Nel complesso, le valutazioni degli studi clinici hanno dimostrato che l’efficacia del vaccino è di circa il 60%. Inoltre, sono state smentite le preoccupazioni che parlavano di inefficacia nei pazienti sopra i 65 anni, dato che gli esperti scientifici dell’EMA ritengono che si possa inoculare anche agli anziani.
Si inietta con due shot, il secondo tra le 4 e 12 settimane dopo il primo. Gli effetti collaterali più comuni sono stati lievi o moderati e sono migliorati entro pochi giorni dalla vaccinazione. I sintomi monitorati dal sistema di farmacovigilanza dell'Ue e altri centri preposti.
Trasparenza su vaccini, Bruxelles mette paletti: al via regime per autorizzare l’export
Se oggi c’è stata una luce verde (dell’EMA), AstraZeneca potrebbe presto trovarsi di fronte ad un nuovo semaforo imprevisto.
Infatti, per affrontare la scarsa trasparenza sull’allocazione di vaccini fuori dai 27 Ue, e alla luce della scarsità di scorte disponibili per le campagne vaccinali, la Commissione ha adottato una misura che assoggetta le esportazioni ad autorizzazione preventiva da parte degli Stati membri.
Un meccanismo “temporaneo”, come ha precisato Ursula Von der Leyen e confermato anche da Valdis Dombrovskis: il regime si applica solo ai vaccini coperti da accordi di acquisto siglati con l’Ue. Sulla “trasparenza mancata” al momento utile, Stella Kyriakides ha ricordato che Bruxelles è la fonte dei “finanziamenti anticipati alle società” che producono i vaccini e che si è fatto tutto il necessario far partire le dosi subito dopo le autorizzazioni. Con il nuovo regime, l’Ue avrà chiaro “dove si stiano effettuando” le consegne.
31 gennaio: il confronto tra Von der Leyen e produttori vaccino
In un’intervista rilasciata ad un’emittente tedesca, la Presidente Von der Leyen, precisava che il contratto tra AstraZeneca e l’Unione europea non lascia spazio a interpretazioni dubbie: “è chiarissimo, ci sono ordini vincolanti”, ha spiegato. E “per il quarto trimestre del 2020 e per il 2021”, le quantità di consegna sono stabilite, ha aggiunto. Il testo “fa riferimento anche a due stabilimenti in Gran Bretagna” impegnati nella produzione del vaccino destinato ai Paesi dell’Ue.
Ne risulta che alla base dell’impasse c’è il modo in cui AstraZeneca ha “gestito” la produzione, punto che verrà affrontato nell’incontro previsto per domenica tra la Von der Leyen e le case farmaceutiche.
Quali vaccini sono stati autorizzati
La Commissione ha concesso l’autorizzazione all’immissione in commercio condizionata per i vaccini sviluppati da BioNTech/Pfizer e Moderna dopo la valutazione positiva dell’EMA. La richiesta di approvare quello di AstraZeneca/Oxford è arrivata il 12 gennaio. Ha poi avviato una “revisione progressiva” del vaccino di Johnson and Johnson. A proposito di immissione in commercio, è di oggi la notizia dell’EMA sulla sicurezza riscontrata nella somministrazione del vaccino Comirnaty, prodotto da BioNTech/Pfizer, dato che i primi dati raccolti confermano che non ci sono stati effetti collaterali “noti” sulle “segnalazioni di sospette reazioni allergiche gravi” sugli anziani.

 Vaccini, Biden favorevole su revoca brevetti. Europa pronta a parlarne
Vaccini, Biden favorevole su revoca brevetti. Europa pronta a parlarne Gaza: il pressing di Biden su Netanyahu per il cessate il fuoco
Gaza: il pressing di Biden su Netanyahu per il cessate il fuoco Netanyahu al Congresso USA tra divisioni, proteste e assenze di peso
Netanyahu al Congresso USA tra divisioni, proteste e assenze di peso